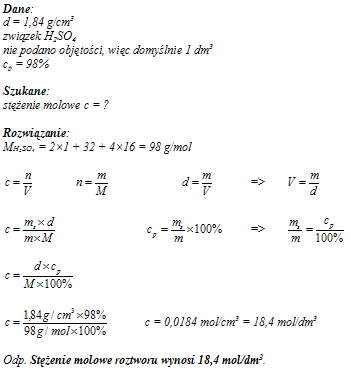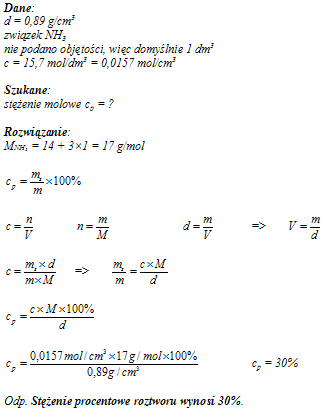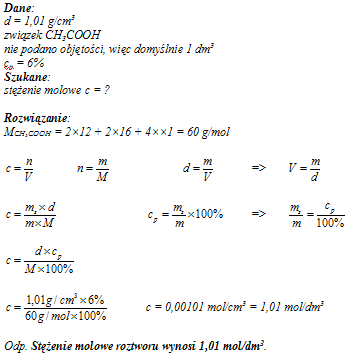Stężenie procentowe
Oblicz stężenie procentowe roztworu, który zawiera 15 g substancji rozpuszczonej w 80 g roztworu.
18,75%
pokaż odp. »« ukryj odp.
Oblicz stężenie procentowe roztworu otrymanego w wyniku rozpuszczenia 80 g NaOH w 150 g wody.
34,8%
pokaż odp. »« ukryj odp.
220 g roztworu KCl zawiera 150 g wody. Oblicz stężenie procentowe takiego roztworu.
31,8%
pokaż odp. »« ukryj odp.
20 g chlorku sodu rozpuszczono w 50 g wody. Oblicz stężenie procentowe tego roztworu.
28,6%
pokaż odp. »« ukryj odp.
Oblicz masę H
2SO
4 zawartego w 400 g 98% kwasu.
392 g
pokaż odp. »« ukryj odp.
1000 kg wody morskiej zawiera 1,3 kg Magnezu. Oblicz stężenie procentowe magnezu w wodzie morskiej.
0,13%
pokaż odp. »« ukryj odp.
Sól kuchenną i wodę zmieszano w proporcji 1:5. Oblicz stężenie procentowe otrzymanego roztworu.
16,7%
pokaż odp. »« ukryj odp.
Przygotowano roztwór bromku sodu w ten sposób, że na 1 g rozpuszczonej soli przypadło 6,23 g wody. Oblicz stężenie procentowe otrzymanego roztworu.
13,8%
pokaż odp. »« ukryj odp.
Aby otrzymać roztwór nasycony pewnej soli trudno rozpuszczalnej, należy rozpuścić w 1 g wody 15,6 mg soli. Oblicz stężenie procentowe tej soli w wodzie.
1,54%
pokaż odp. »« ukryj odp.
Przygotowano roztwór zawierający 24,5 g soli w 100 g wody. Oblicz stężenie procentowe tego roztworu.
19,7%
pokaż odp. »« ukryj odp.
100 dm
3 amoniaku (NH
3) odmierzonego w warunkach normalnych rozpuszczono w 1 dm
3 wody. Oblicz stężenie procentowe otrzymanego roztworu.
7,05%
pokaż odp. »« ukryj odp.
Oblicz stężenie procentowe roztworu otrzymanego po rozpuszczeniu 35 g substancji w 150 cm
3 alkoholu etylowego. Gęstość alkoholu etylowego wynosi 0,78 g/cm
3.
22,9%
pokaż odp. »« ukryj odp.
Oblicz stężenie procentowe roztworu otrzymanego w wyniku rozpuszczenia 1 g substancji w 10 cm
3 wody.
9,1%
pokaż odp. »« ukryj odp.
Oblicz stężenie procentowe roztworu otrzymanego po rozpuszczenu 1 g substancji w 10 cm
3 benzyny, której gęstość wynosi 0,7 g/cm
3.
12,5%
pokaż odp. »« ukryj odp.
Ile gramów chlorku sodu otrzymamy po odparowaniu do sucha 30 g roztworu 6%.
1,8 g
pokaż odp. »« ukryj odp.
Ile soli znajduje się w 0,5 kg roztworu 2%.
10 g
pokaż odp. »« ukryj odp.
Stężenie molowe
Oblicz stężenie molowe roztworu zawierającego 3 mole soli w 8 dm
3 roztworu.
0,375 mol/dm3
pokaż odp. »« ukryj odp.
500 cm3 roztworu azotanu (V) potasu zawiera 0,6 mola soli. Oblicz stężenie molowe roztworu.
1,2 mol/dm3
pokaż odp. »« ukryj odp.
Oblicz liczbę moli NaOH zawartą w 2 dm
3 0,1-molowego roztworu.
0,2 mola
pokaż odp. »« ukryj odp.
Oblicz liczbę moli KOH zawartą w 20 cm
3 2-molowego roztworu zasady.
0,04 mola
pokaż odp. »« ukryj odp.
Jakie jest stężenie molowe roztworu HNO
3, jeżeli w 200 cm
3 znajduje się 1,5 g kwasu?
0,119 mol/dm3
pokaż odp. »« ukryj odp.
Jaka masa NaNO
3 znajduje się w 300 cm
3 roztworu o stężeniu 0,2 mol/dm
3?
5,1 g
pokaż odp. »« ukryj odp.
Oblicz masę CuSO
4 zawartą w 300 cm
3 0,2-molowego roztworu.
9,6 g
pokaż odp. »« ukryj odp.
Oblicz stężenie molowe roztworu soli otrzymanego po rozcieńczeniu wodą 80 g Na
2SO
4 do objętości 500 cm
3.
1,13-molowy
pokaż odp. »« ukryj odp.
Oblicz masę Na
2CO
3 zawartą w 200 cm
3 0,6-molowego roztworu.
12,72 g
pokaż odp. »« ukryj odp.
Oblicz, ile gramów stałego siarczani (VI) potasu potrzeba do przygotowania 350 cm
3 roztworu o stężeniu 0,25 mol/dm
3?
15,22 g
pokaż odp. »« ukryj odp.
Oblicz masę NH
4Cl zawartą w 750 g 0,5-molowego roztworu o gęstości 1,05 g/cm
3.
19,1 g
pokaż odp. »« ukryj odp.
Oblicz stężenie molowe roztworu otrzymanego przez rozpuszczenie 120 g ZnSO
4 w 500 g wody, jeśli gęstość otrzymanego roztworu wynosiła 1,1 g/cm
3.
1,33-molowy
pokaż odp. »« ukryj odp.
Rozpuszczalność substancji
Oblicz masę chlorku strontu potrzebną do otrzymania 200 g nasyconego roztworu, jeśli rozpuszczalność soli w warunkach doświadczenia równa jest 70 g/100 g wody.
82,3 g
pokaż odp. »« ukryj odp.
Oblicz masę soli zawartą w 300 g roztworu KI nasyconego w temperaturze 300 K, jeżeli rozpuszczalność soli w tej temperaturze wynosi 140 g/100 g wody.
175 g
pokaż odp. »« ukryj odp.
Oblicz masę soli i masę wody, jakie należy przygotować w celu uzyskania 400 g roztworu NaCl nasyconego w temperaturze 373 K. Rozpuszczalność NaCl w tej temperaturze wynosi 35 g/100 g wody.
103,7 g soli, 296,3 g wody
pokaż odp. »« ukryj odp.
Rozpuszczalność azotanu (V) baru w temperaturze 20
oC wynosi 8,88 g/100 g H
2O. Oblicz stężenie procentowe nasyconego roztworu tej soli.
8,16%
pokaż odp. »« ukryj odp.
Stężenie nasyconego roztworu KClO
3 wynosi 6,76%. Oblicz rozpuszczalność tego związku.
7,25 g/100 g H2O
pokaż odp. »« ukryj odp.
Do 525 cm
3 roztworu kwasu ortofosforowego (V) o stężeniu 0,01 mol/dm
3 dolano 250 cm
3 wody. Oblicz stężenie molowe tak uzyskanego roztworu.
0,0068 mol/dm3
pokaż odp. »« ukryj odp.
Do 300 cm
3 wody dolano 250 cm
3 roztworu kwasu siarkowego (VI) o stężeniu 0,015 mol/dm
3. Oblicz stężenie molowe tak uzyskanego roztworu.
0,0068 mol/dm3
pokaż odp. »« ukryj odp.
Oblicz, ile cm
3 roztworu siarczanu (VI) potasu o stężeniu 0,75 mol/dm
3 należy rozcieńczyć, aby otrzymać 150 cm
3 roztworu o stężeniu 0,55 mol/dm
3.
110 cm3
pokaż odp. »« ukryj odp.
Oblicz, jaką objętość 0,4-molowego roztworu kwasu siarkowego (VI) należy użyć w celu otrzymania 450 cm
3 0,3-molowego roztworu.
337,5 cm3
pokaż odp. »« ukryj odp.
Oblicz stężenie molowe roztworu uzyskanego przez zmieszanie 350 cm
3 0,02-molowego roztworu siarczanu (VI) magnezu i 100 cm
3 0,012-molowego roztworu tej samej soli.
0,018 mol/dm3
pokaż odp. »« ukryj odp.
Oblicz stężenie molowe roztworu uzyskanego przez zmieszanie 150 cm
3 0,01-molowego roztworu azotanu (V) sodu i 200 cm
3 0,015-molowego roztworu tej samej soli.
0,013 mol/dm3
pokaż odp. »« ukryj odp.
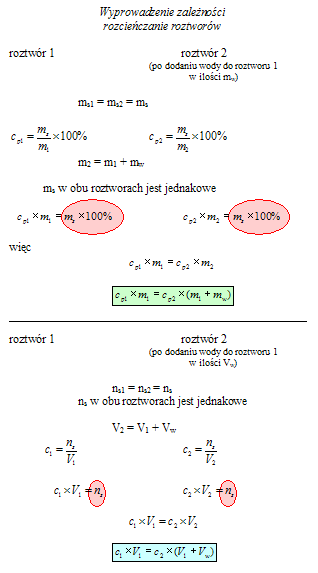
Oblicz masę 20% roztworu wodorotlenku wapnia konieczną do przygotowania 400 g 8% roztworu.
160 g
pokaż odp. »« ukryj odp.
30 g 5% roztworu NaOH zmieszano z 80 g 20% roztworu zasady sodowej. Oblicz stężenie procentowe tego roztworu.
15,9%
pokaż odp. »« ukryj odp.
Zmieszano 40 g 30% roztworu ze 150 g 12% roztworu soli kuchennej. Oblicz stężenie procentowe otrzymanego roztworu.
15,8%
pokaż odp. »« ukryj odp.
Oblicz, jak sporządzić 100 cm
3 roztworu NaOH o stężeniu 0,02 mol/dm
3, dysponując roztworem NaOH o stężeniu 0,4% i gęstości 1 g/cm
3 oraz wodą.
Odmierzyć 20 cm3 roztworu i rozcieńczyć wodą do 100 cm3
pokaż odp. »« ukryj odp.
Oblicz, jaką objętość wody należy dodać do 40 cm
3 roztworu HCl o stężeniu 0,05 mol/dm
3 i gęśtości 1 g/cm
3, aby otrzymać roztwór HCl o stężeniu 0,091%.
40,2 cm3
pokaż odp. »« ukryj odp.
60% roztwór H
2SO
4 ma gęstość 1,5 g/cm
3. Oblicz, jaką objętość tego kwasu należy użyć, aby otrzymać 1 dm
3 roztworu 1-molowego.
108,9 cm3
pokaż odp. »« ukryj odp.
Zmieszano 150 cm
3 0,2-molowego roztworu wodorotlenku sodu o gęśtości 1,05 g/cm
3 i 350 g wody. Oblicz stężenie procentowe tak otrzymanego roztworu.
0,24%
pokaż odp. »« ukryj odp.
Ocet sprzedawany w sklepach ma zazwyczaj stężenie 10%. Oblicz, w jaki sposób należy go rozcieńczyć, aby otrzymać 200 g 3% roztworu używanego do marynat. Oszacuj, czy dużym błędem będzie posłużenie się objętościami, a nie masami wody i octu.
60 g 10% octu i 140 g wody. Ponieważ gęstości roztworów rozcieńczonych są zbliżone do gęstości wody, można odmierzyć 60 cm3 octu i dodać 140 cm3 wody.
pokaż odp. »« ukryj odp.
Oblicz stężenie molowe roztworu otrzymanego przez zmieszanie 50 g 80% H
3PO
4 z 450 cm
3 wody, jeśli wiadomo, że gęstość otrzymanego roztworu wynosiła 1,15 g/cm
3.
0,94-molowy
pokaż odp. »« ukryj odp.
Oblicz, ile gramów wody i ile gramów soli trzeba dodać do 200 g roztworu o stężeniu 5%, żeby otrzymać 300 g roztworu o stężeniu 8%.
msoli=14 g, mwody=86 g
pokaż odp. »« ukryj odp.
Oblicz, ile gramów wody i ile gramów soli trzeba dodać do 50 g roztworu o stężeniu 5%, żeby otrzymać 100 g roztworu o stężeniu 2,5%.
msoli=0 g, mwody=50 g
pokaż odp. »« ukryj odp.
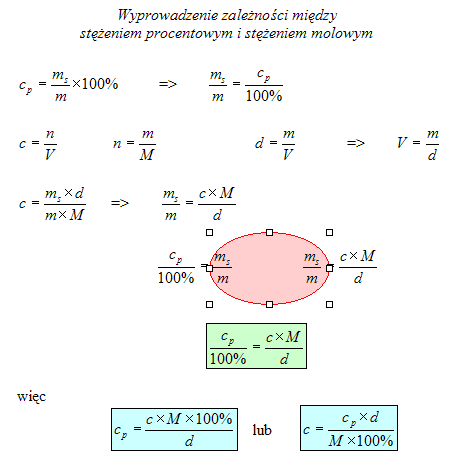
Oblicz masę NaOH potrzebnego do przygotowania 300 g 15% roztworu. Oblicz stężenie molowe tego roztworu, jeśli wiesz, że jego gęstość wynosi 1,2 g/cm
3.
45 g NaOH, 4,5 mol/dm3
pokaż odp. »« ukryj odp.
Oblicz stężenie molowe 98% H
2SO
4 o d = 1,84 g/cm
3.
18,4-molowy
pokaż odp. »« ukryj odp.
pokaż rozwiązanie »« ukryj rozwiązanie
Oblicz stężenie molowe 63% HNO
3 o d = 1,38 g/cm
3.
13,8-molowy
pokaż odp. »« ukryj odp.
Oblicz stężenie procentowe 15,7-molowego roztworu amoniaku (NH
3) o gęstości 0,89 g/cm
3.
30%
pokaż odp. »« ukryj odp.
pokaż rozwiązanie »« ukryj rozwiązanie
Oblicz stężenie procentowe 15,9-molowego roztworu H
3PO
4 o gęstości 1,63 g/cm
3.
95,6%
pokaż odp. »« ukryj odp.
Oblicz stężenie molowe 30% roztworu perhydrolu (H
2O
2) o gęstości 1,11 g/cm
3.
9,8-molowy
pokaż odp. »« ukryj odp.
Oblicz gęstość roztworu formaliny (HCHO), jeśli roztwór 40% jest roztworem o stężeniu molowym równym 14,3 mol/dm
3.
1,11 g/cm3
pokaż odp. »« ukryj odp.
Oblicz gęstość 80% kwasu octoweg (CH
3COOH) o stężeniu 14,3 mol/dm
3.
1,07 g/cm3
pokaż odp. »« ukryj odp.
Pewien tlenowy kwas chloru tworzy roztwór o stężeniu procentowym 50%, a stężeniu molowym równym 10 mol/dm
3. Kwas ten ma gęstość d = 1,01 g/cm
3. Oblicz, jaki to kwas i podaj jego wzór sumaryczny.
HClO4
pokaż odp. »« ukryj odp.
Oblicz stężenie molowe octu spożywczego (roztwór kwasu octowego CH
3COOH o stężeniu procentowym równym 6%), jeżeli wiadomo, że jego gęstość wynosi d = 1,01 g/cm
3.
1,01 mol/dm3
pokaż odp. »« ukryj odp.
pokaż rozwiązanie »« ukryj rozwiązanie

mgr inż. Jacek Maria Nieniewski